Liquid Biopsy – blutbasierte, molekulare Tumoranalyse für solide Tumore
Liquid Biopsy (Flüssigbiopsie) kann zirkulierende DNA solider Tumore in Körperflüssigkeiten (insbesondere im Blutplasma) erkennen. Gewebeproben sind momentan Goldstandard, aber nicht immer verfügbar oder nur sehr schwer zu gewinnen (z.B. bei Lungenkrebs).
Eine Liquid Biopsy kann eingesetzt werden für
- Therapieentscheidung und Krebsbehandlung unterstützen
- Detektion von „targetable“ Mutationen um zielgerichtete Therapien und Immuntherapien zu planen
- Bewertung des Therapieansprechens
- Erkennung von Krankheitsprogression, Resistenzentwicklung gegen die Therapie und klonale Entwicklung
- Frühes Erkennen und Überwachung von Rezidivbildung
- Monitoring molekularer Veränderungen des Tumors und seiner Metastasen
- Detektion von Minimaler Resterkrankung (MRD)
- Bildet die Heterogenität metastasierter Erkrankung ab
Liquid Biopsy – eine verlässliche in-vitro-Diagnostik
Gewebebiopsien sind gegenwärtig Goldstandard, aber gestalten sich für die wiederholte Gewinnung zur Nachbeobachtung von Patienten und zur Beurteilung des Therapieansprechens als nicht praktikabel.
Liquid Biopsy hingegen kann über eine einfache Blutprobe minimal invasiv gewonnen werden, um derartige Informationen zu gewinnen. Liquid Biopsy ist bereits in einigen Leitlinien zur Behandlung von Krebs aufgenommen worden, unter anderem für Lungen-, Darm- und Brustkrebs.
Unsere OncoBEAM™-Technologie war bislang die sensitivste verfügbare Technologie, fast 20x sensitiver als anderen Routine-Technologien wie PCR (Polymerase-Kettenreaktion) oder konventionelle NGS (Next Generation Sequencing).
SafeSEQ ist die Technologie, die das Fundament unserer neuen Plasma-SeqSensei™-Produktreihe bildet. Sie bietet eine mit OncoBEAM™ vergleichbare Sensitivität mit komfortableren Arbeitsabläufen und höher Flexibilität. Durch die Verwendung von UIDs (eindeutige molekulare Kennung) gelingt die Unterscheidung von Lesefehlern der Polymerase und echten Mutationen, was zu einer über 100-fachen Reduktion der NGS-Fehlerrate führt.
Warum Liquid Biopsy?
- Hohe Konkordanz mit Gewebeproben in den meisten Krebsarten
- Minimalinvasiv (Gewebeproben oft schwer zu gewinnen)
- Kosteneffizienter als Gewebeproben
- Komfortabler für Kliniker und Patienten
- Holistische Information über den Tumor (inkl. eventueller Metastasen)
- Information über den Mutationsstaus des Tumors in Echtzeit
Warum Plasma-SeqSensei™ verwenden?
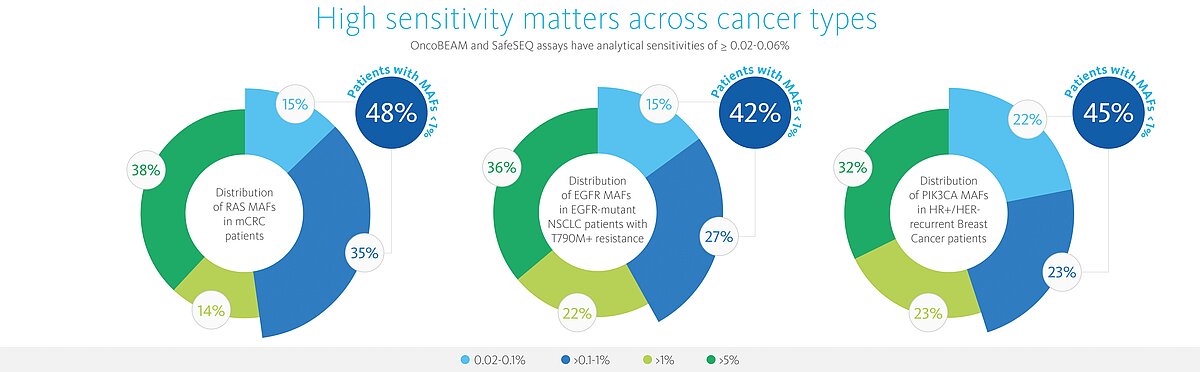
- Hochsensitiv – kann bis zu 6 mutierte Moleküle mit 95% Zuverlässigkeit über alle Mutationen detektieren (absolute Quantifizierung). Dies korrespondiert mit einer Sensitivität von <0.06 % und höhere Tumorfaktion / mutierte Allefraktion (MAF) bei einem DNA-Input von 10.000 GE. Ca. 40% der Proben haben eine MAF unter 1%, was unterhalb der Nachweisgrenze der meisten Technologien liegt.
- Zuverlässige Detektion von Mutationen in krebsrelevanten Genen
- Hohe Flexibilität - zwischen 2-16 Proben/Durchlauf
- Hohe Effizienz für das Labor, da mehrere unterschiedliche Proben in einem Durchlauf analysiert werden können
- Kurze Bearbeitungszeit (2 Tage)
- Einfache IVD-zertifizierte Software
- Minimalinvasive Blutabnahme

Sysmex Inostics ist der weltweite Pionier im Bereich Liquid Biopsy, 2008 gegründet und seit 2013 Teil von Sysmex. Mit mehr als 10 Jahren Erfahrung im Bereich Liquid Biopsy ist Sysmex Inostics ein verlässlicher Partner für führende pharmazeutische Unternehmen und treibt die Markteinführung von effektiver und wirklich personalisierter Therapie voran – von der Entdeckung bis hin zur Begleitdiagnostik.
Unsere Liquid Biopsy IVD Kits
Dr. Bhuwnesh Agrawal - CEO bei Sysmex Inostics - erklärt uns, warum Liquid Biopsy eine so innovative Technologie im Bereich der Krebsdiagnostik ist und wie die neuen Plasma-SeqSensei™ IVD-Kits von Sysmex diese innovative Technologie dem Patienten näherbringen.
Literatur Liquid Biopsy allgemein
[1] National Cancer Institute (2022): Liquid Biopsy
Literatur CRC
[2] Oki et al. (2022): Plasma-informed minimal residual disease (MRD) assay: A multicenter prospective study in Japanese patients with stage II colorectal cancer ASCO GI, Abstract 161 (SafeSEQ)
[3] Lago et al. (2021): Comparison of Plasma-SeqSensei technology with BEAMing liquid biopsy and tissue testing in patients with metastatic colorectal cancer in two Beta-Sites in Spain ESMO, Abstract 4140 (SafeSEQ)
[4] Sloane et al. (2021): Tumor-informed SafeSEQ ctDNA monitoring for treatment response evaluation and detection of minimal residual disease in advanced CRC and NSCLC ASCO, Abstract 342505 (SafeSEQ)
[5] Schmiegel et al. (2017): Blood-based detection of RAS mutations to guide anti-EGFR therapy in colorectal cancer patients: concordance of results from circulating tumor DNA and tissue-based RAS testing Mol Oncol. 11(2): 208-219 (OncoBEAM)
[6] Vidal et al. (2017): Plasma ctDNA RAS mutation analysis for the diagnosis and treatment monitoring of metastatic colorectal cancer patients Annals of Oncol 28 (6): 1325-1332 (OncoBEAM)
[7] Saunders et al. (2016): Performance assessment of blood based RAS mutation testing: concordance of results obtained from prospectively collected samples Annals of Oncol 27 (6): 419-206 (OncoBEAM)
Literatur NSCLC
[1] Sathyanarayan et al. (2021): Rapid liquid biopsy genotyping in NSCLC patients ELCC, J Thorac Oncol 16(4): S788 (SafeSEQ)
[2] Sloane et al. (2021): Clinical evaluation of NGS-based liquid biopsy testing in non-small cell lung cancer (NSCLC) patients Cancer Res 81(13_Suppl): LB053, (SafeSEQ)
[3] Sloane et al. (2021): Tumor-informed SafeSEQ ctDNA monitoring for treatment response evaluation and detection of minimal residual disease in advanced CRC and NSCLC ASCO, Abstract 342505 (SafeSEQ)
[4] Oxnard et al. (2016): Association Between Plasma Genotyping and Outcomes of Treatment With O********** (AZD9291) in Advanced Non–Small-Cell Lung Cancer J Clin Oncol 34(28): 3375-3382 (OncoBEAM)
Literatur MammaCa
[1] Fuentes-Antrás et al. (2021): Orthogonal assessment of PIK3CA and ESR1 mutation detection in longitudinal cfDNA samples from endocrineresistant HR+/HER2- advanced breast cancer patients using dPCR and NGS-based SafeSEQ technology SABCS, Abstract P2-01-18 (SafeSEQ)
[2] Ciriaco et al. (2022): Clearance of ctDNA in triple-negative and HER2-positive breast cancer patients during neoadjuvant treatment is correlated with pathological complete response. Ther Adv Med Oncol 14: 1-12 (SafeSEQ)
[4] Rodriguez et al. (2019): Detection of TP53 and PIK3CA Mutations in Circulating Tumor DNA Using Next-Generation Sequencing in the Screening Process for Early Breast Cancer Diagnosis J. Clin. Med. 8(1183):1-14 (SafeSEQ)